- 首页 > 环状RNA测序
环状RNA测序
环状RNA(circRNA)是一类特殊的非编码RNA分子,与传统的线性RNA(linear RNA)不同,circRNA分子合呈封闭环状结构,且不受RNA外切酶影响,表达更稳定,不易降解。华大推出环状RNA高通量测序服务,可进行环状RNA的鉴定以及环状RNA与miRNA‘’海绵效应‘’分析, 可实现ceRNA(competing endogenous RNAs,内源竞争RNA)机制等研究。可应用在物种环状RNA表达谱构建,环状RNA疾病生物标记开发,环状RNA作用机制研究等方面。
技术优势
信息分析内容
一、标准信息分析
1. 基本数据统计
1.1去除接头序列、低质量序列得到clean data
1.2与核糖体数据库比对,去除核糖体RNA数据
2. 环状RNA预测鉴定
3. 环状RNA所在线性基因注释
4. 环状RNA在基因组上的定位
5. 环状RNA表达定量分析
6. 样品(组)间表达差异分析
二、高级信息分析
1. 差异环状RNA来源的基因GO功能及富集分析
2. 差异环状RNA来源的基因Pathway功能及富集分析
3. 环状RNA与miRNA互作分析(适用于人/小鼠物种)
华大circRNA研究——环状RNA circβ-catenin的翻译通过激活Wnt通路促进肝癌细胞生长
Translation of the circular RNA circβ-catenin promotes liver cancer cell growth through activation of the Wnt pathway. Genome Biol 20, 84 (2019).
研究概要:
目前肝癌是一个全球性健康问题,在过去的几十年里有许多信号通路被证实参与了肝癌的发生,Wnt/catenin通路作为一种高度保守的通路,广泛参与多种病理事件。在本研究中,本次研究利用在线数据库中的RNA测序数据进行分析,确定了一个来自于catenin基因的circRNA,命名为“circβ-catenin”。功能研究表明,敲除circβ-catenin可抑制体内和体外癌细胞的生长。随后的研究表明,circβ-catenin编码一种新的370个氨基酸的β-catenin同工型。该同工型保护β-catenin免受GSK3β介导的降解,从而增强Wnt /β-catenin途径的激活。
研究结果:
1. 人细胞系中WNT通路相关环状RNA的生物学分析以及circβ-catenin在人细胞系和组织中的表达
研究人员计算了7个非癌细胞系和6个癌细胞系中Wnt通路相关环状RNA的数量,发现大多数可以产生数百个Wnt通路相关环状rna。接下来重点关注HepG2细胞系的肝脏来源。发现48个Wnt通路相关基因在HepG2细胞中产生131个环状RNA。通过使用cDNA样本中的发散引物和Sanger测序,证实了头尾剪接(back-splicing)发生在catenin的外显子中。然后设计了收敛型和发散型引物,分别检测线β-catenin mRNA 和环状circβ-catenin。结果提示circβ-catenin比其线性同源β-catenin mRNA更稳定。还进行了Northern blotting检测circβ-catenin和线性β-catenin mRNA的RNA水平。还检查了circβ-catenin蛋白和β-catenin mRNA在不同人体组织中的表达谱,发现circβ-catenin表达与组织中的线性的β-catenin mRNA呈正相关。
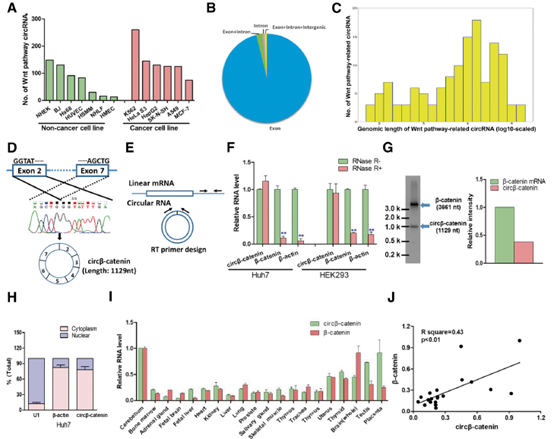
图1. circβ-catenin 在人细胞系和组织中的表达
2. circβ-catenin的敲低抑制肿瘤的生长和转移
为了评估circβ-catenin的生物学重要性,分析了circβ-catenin在肝癌组织中的表达,发现circβ-catenin在肝癌组织中显著升高,针对circβ-catenin的shRNA病毒载体沉默了两种肝癌细胞系中circβ-catenin的RNA水平。然而circβ-catenin的敲除并不影响β-catenin mRNA的表达水平。MTT检测,集落形成检测和流式细胞术检测表明,circβ-catenin的沉默新住抑制了肝癌细胞的生长和细胞周期进展,愈合实验显示,circβ-catenin的沉默抑制了癌细胞的迁移。侵袭实验表明,circβ-catenin的沉默也会损害细胞的侵袭能力,挽救实验表明circβ-catenin的异位表达可以挽救shRNA介导的表型。
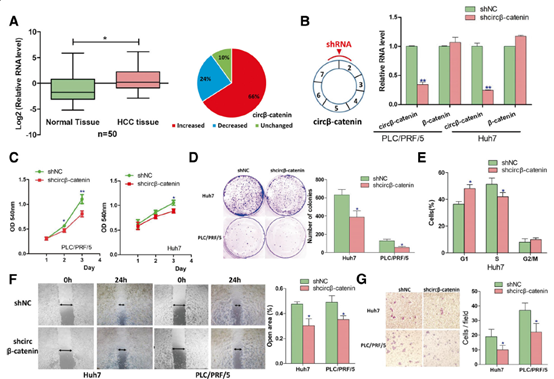
图2. circβ-catenin的敲低体外肝癌细胞的增殖和转移
3. circβ-catenin的沉默抑制了Wnt/β-catenin的通路
为了阐明circβ-catenin在肝癌中的潜在的分子机制,分析了敲除circβ-catenin后的全部RNA的表达谱。RNA-seq的数据的生物信息学分析显示,受circβ-catenin影响的基因在Wnt/catenin通路中显著富集。也通过RT-PCR进行了数据验证。研究人员合成了针对circβ-catenin或β-catenin mRNA的不同siRNA的siRNA, 尽管siRNA不会影响β-catenin的mRNA水平,但是显著降低了β-catenin的蛋白水平。随后的研究表明,靶向circβ-catenin的siRNA可以显着降低带有β-catenin结合位点的TOPflash载体的荧光素酶活性,而不会改变具有突变的β-catenin结合位点的FOPflash载体的荧光素酶活性。
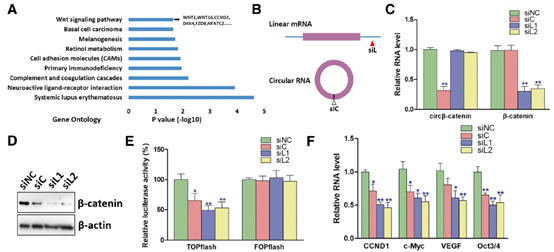
图3. circβ-catenin的敲低抑制了Wnt/β-catenin的通路
CircRNA biomarker鉴定——来自ANXA2基因转录的环状RNA可作为神经性多发性硬化症诊断的biomarker
Circular RNA profiling reveals that circular RNAs from ANXA2 can be used as new biomarkers for multiple sclerosis[J]. Human Molecular Genetics, 2017
发表单位:西班牙Biodonostia健康研究中心等
研究摘要
为寻找多发性硬化症(MS)患病诊断的biomarker,本次采用患病组和对照组各选4个血液白细胞样本进行研究,在406个差异表达环状RNA中找到2个目标环状RNA:circ_0005402和circ_0035560,在20个患病RR-MS个体中和18个正常人中进行验证,使用The Wilcoxon test证实这两个环状RNA在患病中显著低表达。并通过ROC 生存曲线分析:circ_0005402、circ_0035560 敏感性和特异性较高,可作为潜在的临床患病诊断的biomarker。
部分研究结果展示
1、共发现406个差异表达环状RNA,其中324低表达,82高表达;通过qPCR验证10个差异表达环状RNA, 其中5个高表达,5个低表达,其中验证率为90%。
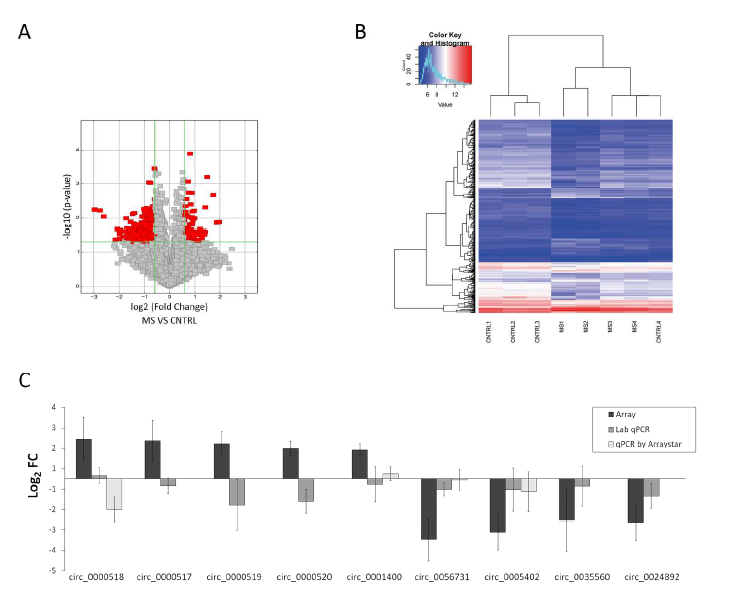
图1 多发性硬化症环状RNA差异分析,a:差异环状RNA火山图分析;b:差异环状RNA聚类图分析;c:qPCR验证结果
2、通过ROC生存分析,结果显示来自ANXA1-mRNA, circ_0003452_2 和circ_0005402具有较高敏感度,可作为潜在诊断的biomarker。
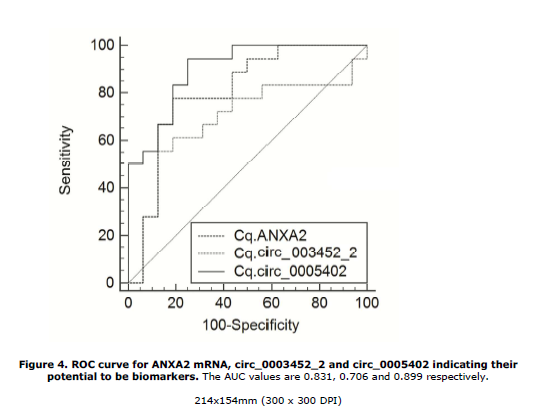
图2 ANXA1-mRNA, circ_0003452_2 and circ_0005402 ROC生存曲线分析

外圈表示染色体,内圈表示以1,000,000个碱基为滑动窗口时,circRNA数目在染色体上的变化。

X轴为样品名称,Y轴为log10(RPB),每个区域的箱线图对应五个统计量(自上而下分别为最大值、上四分位数、中值、下四分位数和最小值)。

X轴代表log2转换后的差异倍数值,Y轴代表-log10转换后的显著性值。红色代表上调的circRNA,蓝色代表下调的circRNA,灰色代表非差异的circRNA。

X、Y轴均代表circRNA表达量的对数值。红色代表上调的circRNA,蓝色代表下调的circRNA,灰色代表非差异的circRNA。

X轴代表聚类分析的样品,Y轴代表差异circRNA。颜色代表log10转换后的表达量(颜色越深表示表达量越高,越浅表示表达量越低)。

X轴代表差异表达circRNA来源基因的数目,Y轴代表GO功能分类。

X轴代表基因所占的比例,Y轴代表KEGG功能分类。将基因根据参与的KEGG代谢通路分为7个分支:细胞过程(Cellular Processes)、环境信息处理(Environmental Information Processing)、遗传信息处理(Genetic Information Processing)、人类疾病(Human Diseasea)(仅限动物)、代谢(Metabolism)、有机系统(Organismal Systems)、药物开发(Drug Development)。

X轴代表富集因子值,Y轴代表通路名称。颜色代表q-value(颜色越白值越大,越蓝值越小),值越小代表富集结果越显著。点的大小代表差异circRNA来源基因的数目(点越大代表数目越大,越小代表数目越少)。Rich Factor指的是富集因子值,是注释上某一通路的前景值(差异circRNA来源基因的个数)与注释上某一通路的背景值(所有circRNA来源基因的个数)之商,数据越大,说明富集结果越明显。
表1 CircRNA组织样品送样建议
|
组织类型 |
具体要求 |
|
新鲜培养细胞(细胞数) |
≥1×106
cell |
|
新鲜动物组织干重 |
≥50 mg |
|
新鲜植物组织干重 |
≥200
mg |
|
全血(哺乳动物) |
≥2.5 mL淋巴细胞 ≥2.5 mL Paxgene
Blood RNA tube / RNAprotect® Animal Blood Tubes收集的全血 |
表2 CircRNA测序样品判定标准
|
样本类型 |
总量 |
浓度 |
RIN |
28S/18S |
基线和 5S |
纯度 |
|
Total RNA |
≥5 μg |
≥40 ng/μL |
RIN≥6.0 |
28S/18S≥1.0 |
基线平整,5S 峰正常 |
无 DNA,蛋白/盐离子等污染,样本无色透明不粘稠 |
|
Total RNA |
≥5 μg |
≥40 ng/μL |
RIN≥7.0 |
28S/18S≥1.0 |
Q1:Total RNA最低送样量是多少?
5 ug/单次,详细可见上面的送样建议。
Q2:环状RNA 推荐数据量?
根据饱和度分析,一般推荐10 G以上数据。
Q3:circRNA需要做生物学重复吗?
需要。至少3个,实际越多越好。
Q4:lncRNA数据分析和环状RNA标准建库流程(R酶富集方法)分析的结果有什么区别?
LncRNA数据(10 G clean data)鉴定到1千到2千个环状RNA,数量级在千位;而富集方法可鉴定到2万-3万个环状RNA,数据量级在万位;两种方式可根据客户研究目的和需求进行针对性推荐,如客户初期研究,可进行lncRNA建库测序方法,具有较高性价比;如果是针对性的研究环状RNA,可推荐环状RNA标准建库方法。
Q5:环状RNA验证方法?
定量验证:根据junction位点设计引物进行qPCR验证;
功能验证:使用circRIP方法验证miRNA Sponge功能;使用miRNA敲除及拮抗等模拟物进行功能验证。
Q6:环状RNA(circRNA)是不是很稳定、不存在降解?
CircRNA即为成环的RNA分子,其特性即是不易被RNase R降解。但是,实际上,降解分两种,一种是RNase R的降解,一种是水解。水解是不区分环状或者非环状的过程,并且事实上环状更容易被水解,因为环状的碱基基团靠的近,羟基更容易去攻击磷酸羟基键。将circRNA放在室温或者60℃或者在镁离子作用下,它们依然较容易被水解。在使用RNase R降解的过程中,体系中含有镁离子(Mg2+),因此实际的操作过程可能存在对circRNA的水解。所以,RNase R降解法获得circRNA的这种操作,可以提高检测的敏感性,但是不能提高特异性。
Q7:如何预测circRNA?
因为在circRNA纯化收集的过程中,需要去除核糖体RNA和线性RNA,然后打断成片段进行建库测序。在得到测序结果后,我们需要对circRNA进行预测鉴定。由于circRNA头尾相接易环化,如果测序结果能获得接头序列(Jumping Sequence),便认为是circRNA。
Q8:CircRNA适宜用芯片技术还是测序技术?
建议使用测序技术,有利于新结果的发现和鉴定。
Q9:样本间鉴定circRNA的差异大吗?
大。样本均一化操作在circRNA中是错误的,因为circRNA不属于上面所提到的“绝大部分基因”(这部分基因在均一化时我们认为几乎没有变化),因此它的含量存在较大变化。

