- 首页 > 蛋白糖基化、乙酰化、泛素化、乳酸化等
蛋白糖基化、乙酰化、泛素化、乳酸化等
糖基化修饰对蛋白质功能和结构的形成具有重要作用,在机体内,细胞粘附、分子识别以及信号转导等过程均涉及糖基化蛋白质的参与。根据糖蛋白糖侧链连结方式的不同,蛋白质糖基化修饰包括O-连接糖基化(O-linked glycosylation)、N-连接糖基化(N-linked glycosylation)等。N-糖基化是蛋白质糖基化修饰中非常普遍和重要的一种修饰,参与了细胞识别、信号转导、黏附、免疫等重要生物过程。
蛋白质乙酰化修饰是在乙酰转移酶的作用下,在赖氨酸残基上添加乙酰基的过程,是一种高度保守的、可逆的翻译后修饰。从组蛋白与DNA的相互作用,到细胞周期的调控,神经退行性疾病,癌症的发生发展等过程,都有赖氨酸乙酰化过程的广泛调控。蛋白质乙酰化在临床方面的应用广泛,主要在代谢疾病中发挥着重要的调控作用,而且去乙酰化酶抑制剂已经成为治疗心脏病、糖尿病和癌症等多种疾病的有潜力的试剂。
蛋白质泛素化修饰在蛋白质降解中的研究最深入。例如,泛素介导的蛋白质降解被证明在细胞周期的运转中发挥着至关重要的作用。最近的研究也发现泛素化蛋白质可能参与细胞内信号转导通路。
乳酸化修饰是乳酸发挥功能的重要方式,参与糖酵解相关细胞功能、巨噬细胞极化、血管功能、线粒体、神经系统调控等重要生命活动,可为肿瘤、免疫等领域的研究指引新方向。
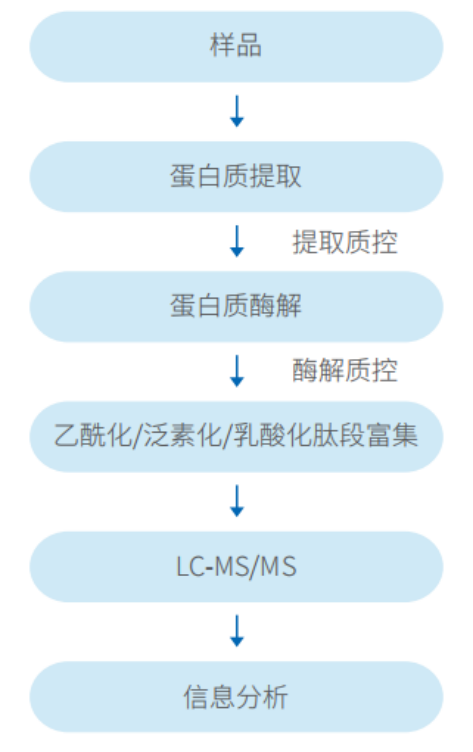
技术路线
 |
|
糖基化蛋白质组定量分析技术流程 | 乙酰化/泛素化/乳酸化蛋白质组定量分析技术流程 |
信息分析
|
信息分析条款 |
信息分析内容 |
|
标准信息分析 |
1 鉴定数量分析 1.1鉴定与定量结果统计 1.2修饰位点分布分析 1.3韦恩图分析 2 表达差异分析 2.1差异表达修饰肽段结果数量统计 2.2差异表达修饰肽段火山图分析 2.3差异表达修饰肽段聚类分析 3 功能分析 3.1修饰位点保守基序分析 3.2差异蛋白结构域分析 3.3差异蛋白亚细胞定位分析 3.4差异蛋白GO功能分析 3.5差异蛋白KEGG通路分析 3.6差异蛋白互作网络分析 |
|
定制化信息分析 |
可结合客户的需求,协商确定定制化信息分析服务内容。 |
1、通过蛋白质组和乙酰化蛋白质组研究衣藻动态光和乙酸依赖的调节机制
Dynamic light-and acetate-dependent regulation of the proteome and lysine acetylome of Chlamydomonas. Plant J. 2021
背景:
衣藻是光合作用和生物燃料生产中最重要的微生物之一,因此详细了解其碳代谢的动态调节对于代谢工程至关重要。
实验设计:
采用二甲基标记技术定量光养、混养、异养生长条件下生长的衣藻蛋白质组和乙酰化蛋白质组,研究蛋白质乙酰化是否受衣藻中碳源可用性的影响。
主要结果:
1)共鉴定了5,863个蛋白质和1,376个乙酰化位点,差异蛋白主要参与光合作用、脂肪酸代谢和乙醛酸循环的各种酶。
2)差异乙酰化蛋白质主要出现于异养和光养之间,异养条件下,Rubisco大亚基的K175和过氧化物酶体柠檬酸合酶的K99和K340的乙酰化水平特别高。
3)还发现乙酰化含量与细胞柠檬酸合成酶活性增加及异养条件下已失活的Calvin-Benson循环相关。


图1 实验流程图(左),KEGG结果图(右)
2、N-糖蛋白组学分析研究干旱胁迫下小麦幼苗叶片的生长机制
Plasma membrane N-glycoproteome analysis of wheat seedling leaves under drought stress. Int J Biol Macromol. 2021.
背景:
细胞膜蛋白参与许多复杂的生理过程,目前细胞膜蛋白质组研究主要集中于人和动物,对植物细胞膜糖蛋白的研究报道很少。小麦是重要的粮食作物,本研究首次对干旱胁迫下小麦幼苗叶片细胞膜糖蛋白进行研究,可识别糖蛋白在干旱胁迫反应中的潜在作用。
实验设计:
利用含20%PEG4000的霍格兰培养液,对三叶期小麦幼苗进行48h、72h和96h的干旱处理,并取叶片,与对照组小麦叶片一起进行膜蛋白提取,之后进行N-糖基化修饰蛋白质组分析。

图2 干旱处理实验设计
主要结果:
1)共鉴定出414个糖基化位点,对应407个糖肽和312个糖蛋白,其中173个细胞膜蛋白具有215个N糖基化位点受干旱胁迫显著变化。
2)功能富集分析表明,差异糖基化蛋白参与细胞外信号接收和转导以及植物细胞壁重塑的蛋白激酶活性密切相关。
3)Motif分表明,79.5%motif位于蛋白表面的无规螺旋和柔性区域,该通过降低蛋白质的柔韧性可促进蛋白质的糖基化修饰,提高蛋白质的结构稳定性。

图3 糖基化蛋白鉴定结果
1、项目概述及质控分析
基于乙酰化蛋白质组定量分析结果,分别从乙酰化肽段、(蛋白)乙酰化位点和乙酰化蛋白(乙酰化肽段对应的蛋白)三个层面统计整体项目以及各样本的鉴定情况。
分别从组内变异系数,主成分分析以及样本定量相关性等方面来评估数据的质量。当样本数目较多时,会在连续上机样本中间断的插入QC样本(QC样本一般为所有样本的混样),从而能在以下质控分析中评估实验条件,以便确保实验的稳定性和重复性。

图1 CV分布图
2、乙酰化肽段定量及差异乙酰化蛋白功能注释
通过差异倍数大于1.5或小于2/3,同时满足统计检验P-value值小于0.05,筛选显著性差异乙酰化肽段。
进一步对差异乙酰化肽段对应的蛋白质,包括GO、COG/KOG和KEGG pathway富集等多种功能注释富集分析。

图2 乙酰化肽段定量及差异乙酰化蛋白富集分析
左图为乙酰化肽段定量分析火山图,横轴为肽段定量值(log2化),纵轴为统计检验的P-value(-log化),分布在该火山图左上右上两区域的肽段为显著差异肽段;中图为差异乙酰化蛋白GO富集分析图,右图为差异乙酰化蛋白KEGG Pathway富集分析气泡图。
表1 乙酰化,泛素化,糖基化送样要求
|
样品类型 |
送样量 |
|||
|
乙酰化 |
泛素化 |
N-糖基化 |
||
|
动物组织类 |
常规动物组织(脑、心、肝、脾、肺、肾、肌肉、皮肤等) |
75mg-2g |
75mg-2g |
30mg-1g |
|
软体动物(血吸虫、旋毛虫等) |
75mg-2g |
70mg-2g |
30mg-1g |
|
|
动物坚韧组织-软骨 |
600mg-5g |
400mg-5g |
200mg-1g |
|
|
动物坚韧组织-毛发 |
75mg-2g |
100mg-2g |
30mg-1g |
|
|
植物组织类 |
柔软组织(木本植物的叶、花等,草本科植物,藻类,蕨类植物,大型真菌等) |
≥3g |
≥3g |
100mg-1g |
|
木本科植物的树根、树皮、树枝等 |
5g-50g |
5g-50g |
3g-25g |
|
|
果实、种子 |
1g-5g |
1g-5g |
0.5g-2g |
|
|
花粉 |
≥3g |
≥3g |
500mg-1g |
|
|
微生物类 |
菌类 |
150mg-2g |
150mg-2g |
50mg-2g |
|
细胞样品 |
悬浮/贴壁培养细胞 |
3×107-5×108 |
2×107-5×108 |
1.5-5×107 |
|
蛋白液 |
总蛋白 |
10mg,最低3mg |
10mg,最低3mg |
1.5mg,最低800μg |
表2 乳酸化送样要求
样品类型 | 送样量 | |
动物组织类 | 常规动物组织(心脏、肝脏、脾脏、肾脏、肺等) | ≥100mg |
植物组织类 | 植物根、茎、叶、果实等 | ≥1g |
微生物类 | 细菌、真菌等 | 细菌菌体 ≥200mg 真菌菌体 ≥1.5g |
细胞样品 | 悬浮/贴壁培养细胞 | ≥3×107 |
Q1:修饰蛋白质组学的研究价值主要在于?
A1:很多生物生命活动的发生和改变,不仅与蛋白的表达量相关,也可能与蛋白的修饰状态相关,常规蛋白质组学主要是在蛋白表达量层面对生物样本进行研究,而修饰蛋白质组学更关注于蛋白的修饰水平,两种技术联用,可以从表达量和修饰水平两个层面进行蛋白质组学研究;相较于常见的转录组 + 蛋白质组从而在中心法则的不同水平研究同一个问题-蛋白表达量,常规 + 修饰蛋白质组学提供了科研的新思路和新选择。
Q2:泛素化位点是如何确定的?
A2:一种特定的翻译后修饰通常会作用于一定的氨基酸,经修饰后,这一类氨基酸会增加相同的分子量,如,在胰蛋白酶消化泛素化蛋白后,泛素依然附着在靶蛋白上,从而产生114Da的质量位移,基于质量偏移的理论,利用生物信息学方法可以分析质谱数据鉴定泛素化翻译后修饰。
Q3:能否做糖链分析及O糖等其他糖型的位点分析?
A3:目前暂不提供糖链结构分析,只是针对N-糖基化蛋白相关的分析,确定蛋白修饰位点;其他糖型暂不能进行分析,在实验过程中采用PNGase F酶进行脱糖步骤,而PNGase F酶只能够切除N-糖链的糖基,所以在质谱分析时只能对N糖进行检测。