- 首页 > 长链非编码 RNA 测序
长链非编码 RNA 测序
LncRNA高通量测序,采用去核糖体链特异性建库方法,对长链非编码 RNA、mRNA 、环状RNA等大RNA进行测序研究,从而快速全面准确地获得与特定生物学过程(例如发育、疾病等)所有大RNA转录本数据信息,可应用于细胞分化和发育的研究、调控机理的研究、疾病标志物的寻找、疾病的分子诊断、基因药物的研发等。

产品优势
1. 超高的技术稳定性
同一样本重复建库相关性Pearson值大于0.993;
2. 丰富的项目经验
已完成万例lncRNA项目,涉及人鼠及动植物物种;
3. 精湛的技术工艺
可承接人、鼠、动植物样品,外泌体、FFPE等,样品起始量低至10ng;
4. Dr.Tom多组学数据挖掘系统交付,分析无忧
一次测序即可获得mRNA、lncRNA、circRNA及关联数据分析结果;
10大数据库注释,多维度结果图片展示,数据图表循环挖掘;
ceRNA、蛋白、共表达、关键驱动基因互作网络分析可视化;
系统随时更新文献信息,查基因得文献,便于文章撰写;
5. 严格的质量管理
实验全程采用全方位质控体系,应用质量管理体系金标准;
6. 贴心的售后支持
7*24小时全天候技术支持,快速响应客户需求。
产品应用
1. 细胞分化和发育调控机理的研究
2. 疾病标志物的寻找
3. 疾病的分子诊断
4. 基因药物的研发
信息分析内容
标准信息分析(circRNA仅限人、小鼠)
1、基本数据统计
① 去除接头序列、低质量序列得到reads信息
② 样品相关性
③ 表达量分布
④ RNA分类
2、参考基因组比对
3、lncRNA、mRNA、circRNA鉴定
4、lncRNA、mRNA、circRNA定量分析
5、lncRNA、mRNA差异表达分析(样本间、组间)
6、lncRNA、mRNA表达/差异基因聚类
7、mRNA差异基因GO分类、富集
8、mRNA差异基因KEGG分类、富集
9、mRNA结构分析
① 可变剪切分析
② 融合基因分析(仅限人)
10、可选:如需circRNA差异表达分析与表达/差异基因聚类分析,可基于交付数据自行在Dr. Tom系统上操作
高级信息分析
(一)数据库注释
1、转录因子注释(AnimalTFDB/PlantTFDB)
2、GSEA分析
3、Rfam、Pfam、Reactome、COG、EggNOG和InterPro数据库注释
(二)互作网络分析
1、靶基因分析
① miRNA-mRNA靶向关系分析
② lncRNA-mRNA靶向关系分析
2、蛋白互作网络分析
3、共表达互作网络分析
(三)特色分析
1、外部数据库关联分析(TCGA、ARCHS4)
2、关键驱动基因网络图分析
3、时间序列分析
案例一、植物盐胁迫相关lncRNA——盐胁迫lncRNA的鉴定与功能研究 [1]
文章题目:The long noncoding RNA LAL contributes to salinity tolerance by modulating LHCB1s' expression in Medicago truncatula
发表期刊:Communications Biology
发表时间:2024年
研究摘要:
长链非编码RNA(lncRNA)在植物中非常丰富,然而它们在大多数生物学过程中的调控作用仍然不清楚,例如在对植物生产有害的盐胁迫响应中。在这里,我们展示了在盐处理的蒺藜苜蓿(Medicago truncatula)中鉴定的一个 lncRNA 对耐盐性很重要。我们将这个 lncRNA 命名为 LAL,即对蒺藜苜蓿光合作用叶绿素a/b结合蛋白(MtLHCB)基因的反义长链非编码 RNA。LAL 是位于染色体 6 上的四个连续MtLHCB 基因的反义链。在盐处理的蒺藜苜蓿中,LAL 在早期被抑制,但后来被诱导;这一模式与四个 MtLHCBs 相反。lal 突变体显示出增强的耐盐性,而在 lal 背景下过表达 LAL 会破坏这种优越的耐盐性,这表明其在盐胁迫响应中的调控作用。通过在烟草叶片中瞬时共表达 LAL 和 MtLHCB1.4-GFP,进一步验证了 LAL 对 MtLHCB1.4 的调控作用,在这一过程中鉴定了 MtLHCB1.4 的切割和干扰 RNA 的产生。这项工作展示了一个 lncRNA LAL,通过调节 MtLHCB1s 的表达,在蒺藜苜蓿中微调耐盐性的作用。
结果展示:
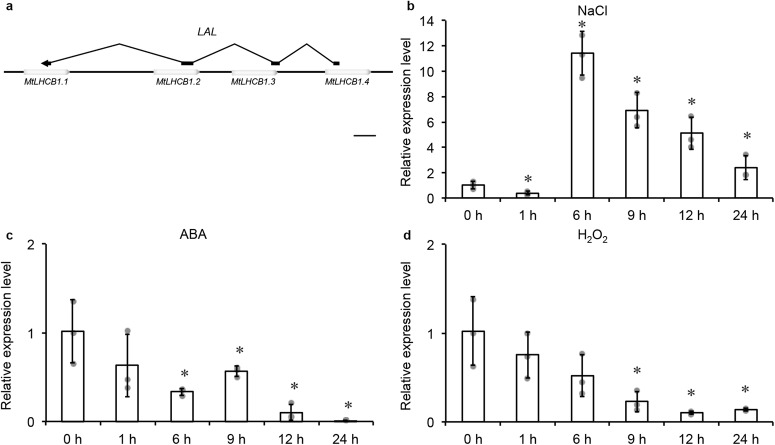
图1 长非编码 RNA-LAL 在盐胁迫、ABA(生长素)和 H2O2(过氧化氢)处理下的表达情况
案例二、肿瘤中的 lncRNA机制——长链非编码RNA 衍生的肽段具有免疫原性 [2]
文章题目:Long non-coding RNA-derived peptides are immunogenic and drive a potent anti-tumour response
发表期刊:Nature Communications
发表时间:2023年
研究摘要:
蛋白质精氨酸甲基转移酶 5(PRMT5)在多种癌症中过度表达,其中主要的转录调控因子 E2F1 是一个重要的甲基化靶标。本研究探索了 PRMT5 和 E2F1 在调节非编码基因组中的作用,并报道了对长链非编码(lnc)RNA 基因表达的显著影响。此外,许多与 MHC 类 I 蛋白相关的肽段来源于 lncRNA 基因中的小开放阅读框。药理学抑制 PRMT5 或调节 E2F1 水平可以定性改变肿瘤细胞展示的 lncRNA 衍生肽段抗原。当以体外负载的树突状细胞或从病毒载体中表达的方式呈现给免疫系统时,lncRNA 衍生的肽段可以驱动 CD8 T 淋巴细胞强大的抗原特异性反应,这导致肿瘤生长的显著抑制。因此,lncRNA 基因编码的免疫原性肽段可以作为癌症疫苗使用。
主要研究结果:

图2 HCT116细胞中lncRNA转录本的差异表达分析。
参考文献:
[1] Zhao Y, Liu Y, Zhang F,et al. The long noncoding RNA LAL contributes to salinity tolerance by modulating LHCB1s' expression in Medicago truncatula. Commun Biol. 2024 Mar 8;7(1):289.
[2] Barczak W, Carr SM, Liu G, et al.Long non-coding RNA-derived peptides are immunogenic and drive a potent anti-tumour response. Nat Commun. 2023 Feb 25;14(1):1078.

图1 lncRNA差异靶基因的聚类热图和KEGG功能富集图

图2 差异表达lncRNA与靶基因的蛋白互作和共表达互作网络图
鼠标指连接线,可以立即展示相关文献信息
表1 lncRNA组织样品送样建议
组织类型 | 具体要求 |
新鲜培养细胞(细胞数) | ≥2×105 cells |
新鲜动物组织干重 | ≥25 mg |
新鲜植物组织干重 | 嫩叶、嫩茎≥100 mg, 根、果实、种子、花等 |
全血(哺乳动物) | ≥1 mL 全血分离的白细胞或 ≥1 mL PAXgene® Blood RNA Tube收集的全血 |
全血(非哺乳动物) | ≥0.1 mL 全血分离的白 |
FFPE | ≥5片,未染色,100 mm2,5-10 μm厚度 |
表2 lncRNA测序样品判定标准
|
样本类型 |
总量 |
浓度 |
RIN |
28S/18S |
|
Total RNA |
≥200 ng |
20-500 ng/μL |
RIN≥6.0 |
28S/18S≥1.0 |
|
(human/mouse/rat) |
||||
|
Total RNA
(Cell: |
≥200 ng |
20-500 ng/μL |
RIN≥7.0 |
28S/18S≥1.0 |
|
human/mouse/rat) |
||||
|
Total RNA (Plant) |
≥1
μg |
40 -1000 ng/μL |
RIN≥6.0 |
28S/18S≥1.0 |
|
Total RNA |
≥1 μg |
40 -1000 ng/μL |
RIN≥6.0 |
28S/18S≥1.0 |
|
(Animal) |
||||
|
Total RNA
(Insect) |
≥1 μg |
40 -1000 ng/μL |
RIN≥6.0 |
N/A |
|
FFPE RNA |
≥200 ng |
70-500 ng/μL |
RIN≥2.0 |
DV200≥45% |
*备注:
(1)基线和5S:基线平整,5S 峰正常
(2)纯度:无 DNA,蛋白/ 盐离子等污染, 样本无色透明 不粘稠,细胞样本无 16S 和 23S 峰。
Q1:什么是长链非编码RNA?以及它们的作用?
哺乳动物基因组序列的约5%~10%被稳定转录,蛋白质编码基因仅约占1%,其余4%~9%的序列都转录为非编码RNA。而非编码RNA(non-coding RNA) 是指不能翻译为蛋白的功能性RNA分子。长链非编码RNA为这4%~9%中长度大于200nt的非编码RNA。它们的作用主要体现在四个方面:第一,影响周边基因的表达;第二,调控蛋白质活动及定位;第三,产生小分子RNA;第四,对其他RNA的调控作用[1]。
Q2:长链非编码RNA的建库方案是什么?
长链非编码RNA建库主要采用去除rRNA,构建链特异性文库,目前建库比较稳定。适用于人、鼠、动植物等物种。
Q3:长链非编码RNA主要签约风险有哪些?
rRNA去除效率不稳定,rRNA比例可能较高;只去除rRNA较适用于有良好参考基因组的项目,后续可以通过比对区分编码和非编码序列。
Q4:在信息分析中主要运用到的软件有哪些?
Tophat和Cufflinks(构建转录本),Infernal(家族分类),CPC(对转录本编码能力进行预测),Blast(比对),SOAP(过滤实验中未去除干净的rRNA,及lncRNA表达定量比对)。
Q5:长链非编码RNA建库测序结果可以用于分析环状RNA吗?
可以,长链非编码RNA建库模式采用去核糖体方式建库,对所获得的RNA进行打断测序,相当于获得全部RNA,即可以进行分析环状RNA表达情况,可应用于分析各物种环状RNA表达谱。
Q6:LncRNA测序数据中mRNA的定量效果如何?
人标品:已知mRNA定量与qPCR定量斯皮尔曼系数达到0.88。

