- 首页 > TMT蛋白定量分析
TMT蛋白定量分析
定量蛋白质组学(Quantitative Proteomics)是对一个基因组表达的全部蛋白质或一个复杂混合体系内所有蛋白质进行精确鉴定和定量。可用于筛选和寻找任何因素引起的样本之间的差异表达蛋白,结合生物信息学揭示细胞生理病理功能,同时也可对某些关键蛋白进行定性和定量分析。
TMT(Tandem Mass Tag)串联质谱标记技术是由Thermo公司研发的一种体外同重同位素标记的相对与绝对定量技术。蛋白定量TMT技术利用多种同位素试剂标记蛋白多肽N末端或赖氨酸侧链基团,包括4plex、8plex、16plex等不同数量标签的产品,经高精度质谱仪串联分析,最新推出的TMTpro 18plex可同时比较多达18个样品之间的蛋白组表达量差异,是近年来定量蛋白质组学常用的高通量筛选技术。

图1 TMT试剂结构
产品优势
- 通量高:可同时对2-18种以内实验样本进行蛋白组定量分析和比较;
- 周期短:标记混合上样大幅度压缩机时,缩短项目周期;
- 重复性高:采用多个标记样本同时上机的方法,避免样本分别上机检测和传统制胶实验重复性差的问题;
- 经验丰富:10余年丰富项目经验,40+项质控保障,200+篇质谱文章发表;
- 云平台交付:采用Dr. Tom云平台进行数据交付,便于开展零生信基础的数据挖掘,以及同转录组的自主关联分析;
- 一站式、多组学服务:提供经典的蛋白质组非靶向发现+靶向验证一站式服务;以及蛋白质组+转录组、蛋白质组+代谢组、常规蛋白质组+磷酸化蛋白质组学等一系列多组学关联分析服务。
产品应用
- 人类疾病研究:
疾病生物标志物筛选和验证
疾病发生发展过程中的蛋白表达调控机制
药效评估
- 动植物基础研究:
重要农作物农艺性及其改良措施
动植物生长发育机制研究
抗逆抗病机制研究
- 微生物领域研究:
致病机理研究
耐药性研究
宿主-微生物的相互作用机制研究
技术路线
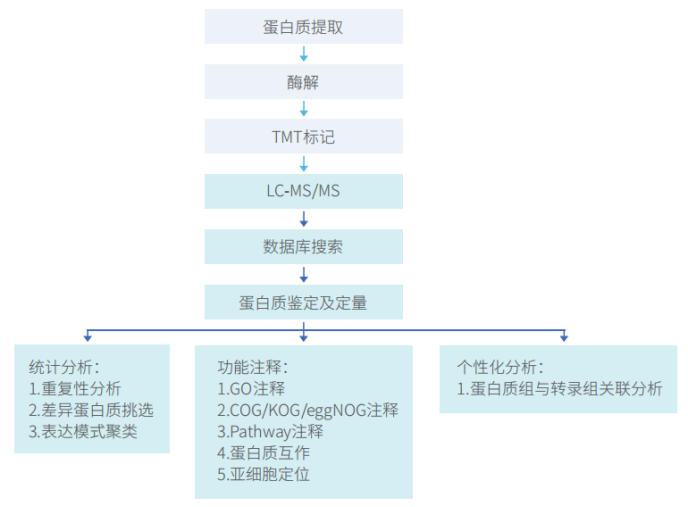
信息分析
|
信息分析条款 |
信息分析条款 |
|
标准信息分析 |
1 标准信息分析内容 1.1 数据产出统计 1.2 蛋白质鉴定结果 1.3 蛋白质定量结果 1.4 蛋白质GO分析 1.5 蛋白质KOG/COG/eggNOG分析 1.6 蛋白质Pathway代谢通路分析 1.7 差异蛋白的GO富集分析 1.8 差异蛋白的Pathway富集分析 1.9 差异蛋白KOG/COG/eggNOG富集分析 1.10 重复性分析(仅针对设计了重复的实验) 1.11多样品间表达模式聚类(三个或三个以上样品可提供) 1.12 差异表达蛋白互作分析 1.13 差异表达蛋白亚细胞定位 1.14 蛋白信号调控分析(针对人和小鼠) 配体-受体调控分析,激酶-底物调控分析,转录因子-靶蛋白调控,蛋白信号调控分析 |
1、TMT蛋白定量+RNA-Seq多组学利器研究肾脏衰老的分子机制
Proteomics and transcriptomic profiling reveal different aspects of aging in the kidney. eLife. 2021
背景:
衰老的特点是所有器官生理功能下降、发病率和死亡率增加。而肾功能在衰老的早期就会受到影响,并随年龄的增长逐渐下降;通过血液和尿液测量肾脏的功能变化相对容易和无创;此外肾脏功能能显著影响其他器官的衰老相关疾病,如认知障碍。因此肾脏是研究器官特异性衰老的一个极好的模型。虽然肾功能的生理变化已经得到了很好的阐述,但人们对驱动年龄相关功能丧失的潜在分子机制仍知之甚少。
方案设计:
188只多样性远系繁殖(DO)小鼠的右肾组织,包括6个月大的30只雄性和33只雌性小鼠、12个月大的31只雄性和31只雌性小鼠、18个月大的34只雄性和29只雌性小鼠。
主要结果:
1)mRNA和蛋白质随年龄产生的变化与免疫浸润增加和线粒体功能下降有关;
2)与mRNA相比,蛋白质表现出更大程度的变化,并揭示了一系列广泛的生物过程的变化,包括肾脏老化的独特的、器官特异性的特征;
3)研究还发现在mRNA没有相应变化的情况下,蛋白质中与年龄相关的功能产生了变化。表明mRNA只能提供肾脏分子老化的不完整数据,同时检测蛋白质的变化对于理解不受转录调控的老化过程至关重要。

图1 年龄相关的蛋白质表达量变化并不是由mRNA表达所介导的
2、iTRAQ+MRM揭示蝴蝶兰春化作用分子机制
Proteomic Analysis of the Early Development of the Phalaenopsis amabilis Flower Bud under Low Temperature Induction Using the iTRAQ/MRM Approach. Molecules. 2020.
背景:
蝴蝶兰(Phalaenopsis amabilis)是一种经过春化、需要低温处理才能开花的兰花,造型优美,花色艳丽,是国际花卉市场上最重要的植物之一。然而当前关于蝴蝶兰的花发育相关的蛋白质组学研究报道较少。
实验设计:
利用iTRAQ对常温和低温处理0、10和20天的蝴蝶兰花芽进行蛋白质组学分析,对属于春化作用途径的差异表达蛋白利用靶向蛋白质组学MRM技术验证。
主要结果:
1)利用iTRAQ对常温和低温处理下的蝴蝶兰进行蛋白质组学分析,共鉴定到了5,064个蛋白,其中42个差异蛋白属于光周期、春化途径、激素途径、碳代谢、能量代谢和应激反应相关;
2)对与春化途径相关的蛋白质中,PEQU_11434和PEQU_19304上调,且通过MRM技术得到验证。推测O-GlcNAc糖基化参与VRN1的转录后修饰,GRP2蛋白(富含甘氨酸的RNA结合蛋白)糖基化减轻其与VRN1前体mRNA的结合,促进VRN1的表达和开花。

图2 差异蛋白KEGG Pathway富集分析
1、蛋白鉴定结果
表1 蛋白鉴定情况

2、蛋白定量结果
TMT定量由华大开发软件IQuant来实现。单次实验的显著差异蛋白以Fold change ≥ 1.2 和Q-value < 0.05 两个条件筛选。

3、差异蛋白分析
差异蛋白聚类分析和多种功能注释富集分析。

4、差异蛋白互作分析和亚细胞定位
蛋白之间通常通过相互作用结合成复合物之后行使相应的功能,华大提供对差异表达蛋白的互作分析。蛋白质在核糖体中合成后经蛋白质分选信号引导后被转运到特定的细胞器中,部分蛋白质则被分泌到细胞外或留在细胞质中,只有转运到正确的部位才能参与细胞的各种生命活动。蛋白质的亚细胞定位是蛋白功能注释的重要部分。

1、组织类样品送样要求
表1 组织类样品送样要求
| 样品类型 | 送样量 | 备注 |
| 新鲜动物组织干重 | ≥10mg | 富含杂质或蛋白质含量低的样品量干重≥5g,如植物的根、木质部、韧皮部组织等 |
植物和蕈类真菌(如蘑菇、木耳)类 样品量湿重 | ≥300mg | |
| 酵母、霉菌类真菌和细菌、噬菌体等微生物 | ≥50mg,或细胞数≥5×106 | |
| 新鲜培养细胞数(个) | ≥5×106(细胞沉淀体积约30μl~50μl左右) | |
| 客户分离好的外泌体 | ≥300μL,约1011 浓Particles/mL | |
| 血液类(去高丰度) | 血清、血浆≥200µl | 解冻后血细胞会破裂,蛋白溶出来会影响分析,因此一般不建议送全血 |
2、蛋白类样品送样要求
表2 蛋白类样品送样要求
|
样本类型 |
送样量 |
|
蛋白液 |
≥100μg,浓度≥0.5µg/µL |
Q1:TMT等标记定量怎样设置重复?
A2:推荐至少进行3次或以上生物学重复,否则实验结果一般不能被杂志接收。
Q2:不同试验的样本做TMT等标记定量可否放在一组上机?
A3:不能。因为不同试验的研究对象一般有差异,即便是同样的物种,处理方式也会有不同,这种情况下,不同来源的样本混在一起上机,会大大提高样本中蛋白种类的复杂程度,影响质谱的分辨能力,降低蛋白鉴定数目和定量效果。所以不同来源的样本,蛋白表达差异过大者,必须分别上机进行检测。
Q3:为什么有些差异表达基因在蛋白层面没有相应的差异蛋白?
A4:从生物学角度看,由于RNA调控、蛋白降解、蛋白分泌、转录和翻译效率不一致等原因,导致蛋白水平和转录水平未必呈现一样的趋势,这是正常现象。
Q4:只通过TMT等蛋白标记定量技术找到的差异蛋白,可否直接认定为biomarkers?
A5:从生物实验的角度来讲,通过一种实验得到的结果是需要再进行验证的。在发现阶段,用TMT等标记定量技术找到的差异蛋白,一般还需要通过其他技术进行验证后,再得出最终的结论,推荐采用目标蛋白定量MRM/PRM技术,或者传统的western blotting(Western Blot)技术进行验证。

