- 首页 > 环状RNA测序
环状RNA测序
环状RNA(circRNA)是一类特殊的非编码RNA分子,与传统的线性RNA(linear RNA)不同,circRNA分子合呈封闭环状结构,且不受RNA外切酶影响,表达更稳定,不易降解。华大推出环状RNA高通量测序服务,可进行环状RNA的鉴定以及环状RNA与miRNA‘’海绵效应‘’分析, 可实现ceRNA(competing endogenous RNAs,内源竞争RNA)机制等研究。可应用在物种环状RNA表达谱构建,环状RNA疾病生物标记开发,环状RNA作用机制研究等方面。
技术优势

信息分析内容
一、标准信息分析
1. 数据处理:
1.1 对原始数据进行去除接头和低质量 reads 的处理
1.2 测序质量评估
1.3 过滤核糖体 RNA
1.4 参考基因组比对
2. CircRNA 预测及注释
3. CircRNA 外显子及可变剪切
4. CircRNA 来源基因鉴定
5. CircRNA 表达定量
5.1 CircRNA 定量分析
5.2 样品相关性分析
5.3 样品间共有表达基因及特异表达基因维恩图
5.4 样品间 CircRNA 表达量聚类
6. 差异表达 CircRNA 检测
7. 差异表达 CircRNA 聚类分析
8. 差异表达 CircRNA 聚类分析
二、高级信息分析
1. 差异 CircRNA 来源基因 GO 功能分析
2. 差异 CircRNA 来源基因 Pathway 功能分析
3. miRNA 靶向环状 RNA 预测
华大circRNA研究——环状RNA circβ-catenin的翻译通过激活Wnt通路促进肝癌细胞生长
Translation of the circular RNA circβ-catenin promotes liver cancer cell growth through activation of the Wnt pathway. Genome Biol 20, 84 (2019).
研究概要:
目前肝癌是一个全球性健康问题,在过去的几十年里有许多信号通路被证实参与了肝癌的发生,Wnt/catenin通路作为一种高度保守的通路,广泛参与多种病理事件。在本研究中,本次研究利用在线数据库中的RNA测序数据进行分析,确定了一个来自于catenin基因的circRNA,命名为“circβ-catenin”。功能研究表明,敲除circβ-catenin可抑制体内和体外癌细胞的生长。随后的研究表明,circβ-catenin编码一种新的370个氨基酸的β-catenin同工型。该同工型保护β-catenin免受GSK3β介导的降解,从而增强Wnt /β-catenin途径的激活。
研究结果:
1. 人细胞系中WNT通路相关环状RNA的生物学分析以及circβ-catenin在人细胞系和组织中的表达
研究人员计算了7个非癌细胞系和6个癌细胞系中Wnt通路相关环状RNA的数量,发现大多数可以产生数百个Wnt通路相关环状rna。接下来重点关注HepG2细胞系的肝脏来源。发现48个Wnt通路相关基因在HepG2细胞中产生131个环状RNA。通过使用cDNA样本中的发散引物和Sanger测序,证实了头尾剪接(back-splicing)发生在catenin的外显子中。然后设计了收敛型和发散型引物,分别检测线β-catenin mRNA 和环状circβ-catenin。结果提示circβ-catenin比其线性同源β-catenin mRNA更稳定。还进行了Northern blotting检测circβ-catenin和线性β-catenin mRNA的RNA水平。还检查了circβ-catenin蛋白和β-catenin mRNA在不同人体组织中的表达谱,发现circβ-catenin表达与组织中的线性的β-catenin mRNA呈正相关。

图1. circβ-catenin 在人细胞系和组织中的表达
2. circβ-catenin的敲低抑制肿瘤的生长和转移
为了评估circβ-catenin的生物学重要性,分析了circβ-catenin在肝癌组织中的表达,发现circβ-catenin在肝癌组织中显著升高,针对circβ-catenin的shRNA病毒载体沉默了两种肝癌细胞系中circβ-catenin的RNA水平。然而circβ-catenin的敲除并不影响β-catenin mRNA的表达水平。MTT检测,集落形成检测和流式细胞术检测表明,circβ-catenin的沉默新住抑制了肝癌细胞的生长和细胞周期进展,愈合实验显示,circβ-catenin的沉默抑制了癌细胞的迁移。侵袭实验表明,circβ-catenin的沉默也会损害细胞的侵袭能力,挽救实验表明circβ-catenin的异位表达可以挽救shRNA介导的表型。

图2. circβ-catenin的敲低体外肝癌细胞的增殖和转移
3. circβ-catenin的沉默抑制了Wnt/β-catenin的通路
为了阐明circβ-catenin在肝癌中的潜在的分子机制,分析了敲除circβ-catenin后的全部RNA的表达谱。RNA-seq的数据的生物信息学分析显示,受circβ-catenin影响的基因在Wnt/catenin通路中显著富集。也通过RT-PCR进行了数据验证。研究人员合成了针对circβ-catenin或β-catenin mRNA的不同siRNA的siRNA, 尽管siRNA不会影响β-catenin的mRNA水平,但是显著降低了β-catenin的蛋白水平。随后的研究表明,靶向circβ-catenin的siRNA可以显着降低带有β-catenin结合位点的TOPflash载体的荧光素酶活性,而不会改变具有突变的β-catenin结合位点的FOPflash载体的荧光素酶活性。

图3. circβ-catenin的敲低抑制了Wnt/β-catenin的通路
CircRNA biomarker鉴定——来自ANXA2基因转录的环状RNA可作为神经性多发性硬化症诊断的biomarker
Circular RNA profiling reveals that circular RNAs from ANXA2 can be used as new biomarkers for multiple sclerosis[J]. Human Molecular Genetics, 2017
发表单位:西班牙Biodonostia健康研究中心等
研究摘要
为寻找多发性硬化症(MS)患病诊断的biomarker,本次采用患病组和对照组各选4个血液白细胞样本进行研究,在406个差异表达环状RNA中找到2个目标环状RNA:circ_0005402和circ_0035560,在20个患病RR-MS个体中和18个正常人中进行验证,使用The Wilcoxon test证实这两个环状RNA在患病中显著低表达。并通过ROC 生存曲线分析:circ_0005402、circ_0035560 敏感性和特异性较高,可作为潜在的临床患病诊断的biomarker。
部分研究结果展示
1、共发现406个差异表达环状RNA,其中324低表达,82高表达;通过qPCR验证10个差异表达环状RNA, 其中5个高表达,5个低表达,其中验证率为90%。

图1 多发性硬化症环状RNA差异分析,a:差异环状RNA火山图分析;b:差异环状RNA聚类图分析;c:qPCR验证结果
2、通过ROC生存分析,结果显示来自ANXA1-mRNA, circ_0003452_2 和circ_0005402具有较高敏感度,可作为潜在诊断的biomarker。

图2 ANXA1-mRNA, circ_0003452_2 and circ_0005402 ROC生存曲线分析
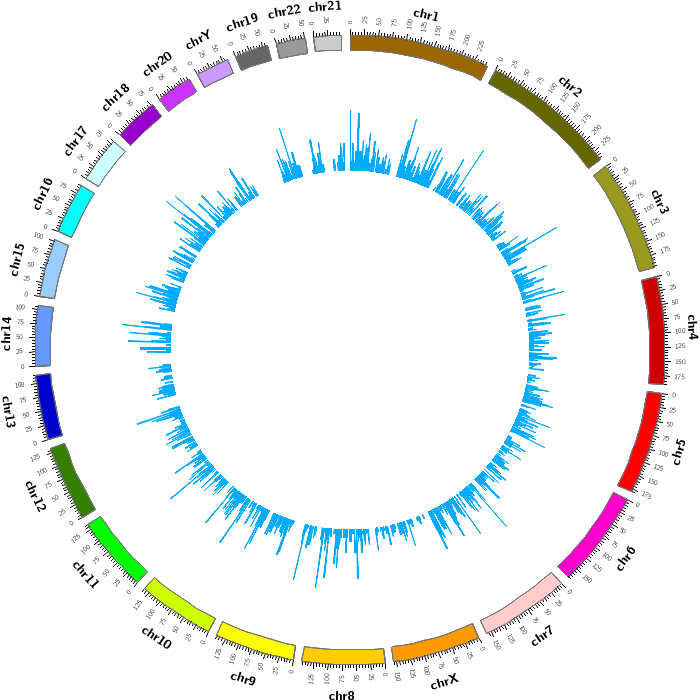
图1 circRNA数目在基因组上的分布图
外圈表示染色体,内圈表示以1,000,000个碱基为滑动窗口时,circRNA数目在染色体上的变化。
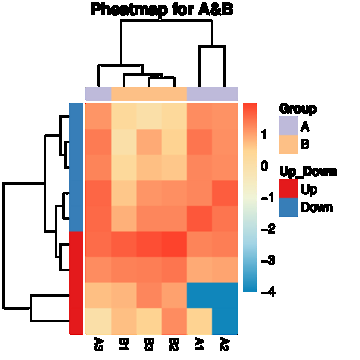
图2 差异circRNA的表达量热图
X轴代表聚类分析的样品,Y轴代表差异circRNA。颜色代表log10转换后的表达量(颜色越深表示表达量越高,越浅表示表达量越低)。
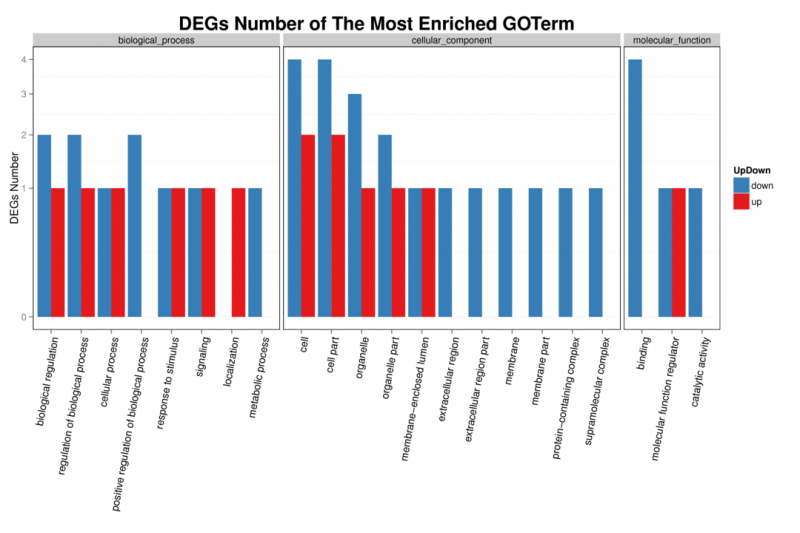
图3 上、下调circRNA的来源基因GO功能分类统计图
X轴代表GO功能分类,Y轴表示对应 GO Term 中上、下调circRNA来源基因的数目。
表1 CircRNA组织样品送样建议
|
组织类型 |
具体要求 |
|
新鲜培养细胞(细胞数) |
≥1×106
cells |
|
新鲜动物组织干重 |
≥50 mg |
|
新鲜植物组织干重 |
≥200 mg |
|
全血(哺乳动物) |
≥2.5 mL 全血分离的白细胞或 ≥1 mL
PAXgene® Blood RNA Tube收集的全血 |
|
FFPE |
≥5片,未染色,100 mm2,5-10 μm厚度 |
表2 CircRNA测序样品判定标准
|
样本类型 |
总量 |
体积 |
浓度 |
RIN |
28S/18S |
|
Total RNA (Plant) |
≥2μg |
≥15μL |
≥40 ng/μL |
RIN≥6 |
28S/18S≥1.0 |
|
Total RNA (Animal) |
≥2μg |
≥15μL |
≥40 ng/μL |
RIN≥7.0 |
28S/18S≥1.0 |
*备注:
(1)基线和5S:基线平整,5S 峰正常
(2)纯度:无 DNA,蛋白/ 盐离子等污染, 样本无色透明 不粘稠
Q1:Total RNA最低送样量是多少?
2 μg/单次,详细可见上面的送样建议。
Q2:环状RNA 推荐数据量?
根据饱和度分析,一般推荐10 G以上数据。
Q3:circRNA需要做生物学重复吗?
需要。至少3个,实际越多越好。
Q4:lncRNA数据分析和环状RNA标准建库流程(R酶富集方法)分析的结果有什么区别?
LncRNA数据(10 G clean data)鉴定到1千到2千个环状RNA,数量级在千位;而富集方法可鉴定到2万-3万个环状RNA,数据量级在万位;两种方式可根据客户研究目的和需求进行针对性推荐,如客户初期研究,可进行lncRNA建库测序方法,具有较高性价比;如果是针对性的研究环状RNA,可推荐环状RNA标准建库方法。
Q5:环状RNA验证方法?
定量验证:根据junction位点设计引物进行qPCR验证;
功能验证:使用circRIP方法验证miRNA Sponge功能;使用miRNA敲除及拮抗等模拟物进行功能验证。
Q6:环状RNA(circRNA)是不是很稳定、不存在降解?
CircRNA即为成环的RNA分子,其特性即是不易被RNase R降解。但是,实际上,降解分两种,一种是RNase R的降解,一种是水解。水解是不区分环状或者非环状的过程,并且事实上环状更容易被水解,因为环状的碱基基团靠的近,羟基更容易去攻击磷酸羟基键。将circRNA放在室温或者60℃或者在镁离子作用下,它们依然较容易被水解。在使用RNase R降解的过程中,体系中含有镁离子(Mg2+),因此实际的操作过程可能存在对circRNA的水解。所以,RNase R降解法获得circRNA的这种操作,可以提高检测的敏感性,但是不能提高特异性。
Q7:如何预测circRNA?
因为在circRNA纯化收集的过程中,需要去除核糖体RNA和线性RNA,然后打断成片段进行建库测序。在得到测序结果后,我们需要对circRNA进行预测鉴定。由于circRNA头尾相接易环化,如果测序结果能获得接头序列(Jumping Sequence),便认为是circRNA。
Q8:CircRNA适宜用芯片技术还是测序技术?
建议使用测序技术,有利于新结果的发现和鉴定。
Q9:样本间鉴定circRNA的差异大吗?
大。样本均一化操作在circRNA中是错误的,因为circRNA不属于上面所提到的“绝大部分基因”(这部分基因在均一化时我们认为几乎没有变化),因此它的含量存在较大变化。

