- 首页 > 全转录组
全转录组
全转录组高通量测序,采用去核糖体链特异性建库方法和小片段富集筛选建库方法,可实现编码RNA和非编码RNA的建库、测序、信息分析及联合分析、ceRNA等,从而快速全面准确地获得与特定生物学过程(例如发育、疾病等)所有大RNA转录本数据信息,这一项研究将调控机制研究延伸到“ 网、多层面”结合的立体模式,有助于相对全面解读生物学现象。
推荐方案
推荐两种测序策略方案:
1) 经济型模式-两种文库测序:LncRNA-Seq + Small RNA
大RNA研究:采用LncRNA-Seq测序模式,即采用去核糖体链特异性建库模式,进行PE100测序模式,10G Clean data;实现lncRNA、mRNA、circRNA鉴定和定量、以及功能分析;
小RNA研究:采用富集小RNA片段建库方法,进行有方向性的SE50测序模式,20M clean reads,实现miRNA、siRNA以及piRNA鉴定和定量,以及功能分析等;
2) 大容量模式-三种文库测序:LncRNA-Seq+ Small RNA+ CircRNA
大RNA研究:采用LncRNA-Seq测序模式,即采用去核糖体链特异性建库模式,进行PE100测序模式,10G Clean data;实现lncRNA、mRNA、鉴定和定量、以及功能分析;
环状RNA研究:采用去除线性RNA,反向富集环状RNA建库方法,进行PE100测序模式,10G clean data,对环状RNA高深度测序,实现对低丰度的环状RNA鉴定和定量及功能分析;
小RNA研究:采用富集小RNA片段建库方法,进行有方向性的SE50测序模式,20M clean reads,实现miRNA、siRNA以及piRNA鉴定和定量,以及功能分析等;
以上两种模式,还可以实现大RNA和小RNA互作网络分析,以及内源竞争性RNA鉴定和网络分析。
生物分析思路图

产品优势
实验严谨
建库工艺稳定,技术重复性高,可接受多种类型样本,total RNA最低起始量低至400ng;
分析全面
包含RNA互作模式,及ceRNA竞争网络分析等,从平面调控研究延伸至立体调控研究;
数据交互
采用Dr.Tom多组学数据挖掘系统,10大数据库注释,多维度结果图片展示,数据图表循环挖掘;
质控严格
实验操作及信息分析操作采用全方位及先进的质量管理体系标准。
产品应用
动植物生长发育的研究
抗逆、抗病虫害调控机理的研究
细胞分化和发育的研究
肿瘤发生发展及转移研究
案例一、lncRNAs 和 mRNA 的共表达网络—基因拷贝数变异相关的非编码 RNA 与先天性心脏病[1]
研究目的:研究基因拷贝数变异(CNVs)中的 lncRNAs(CNV-lncRNAs)是否促成与 CHD 相关的 CNVs 的病因尚待探索
研究样本:从孕四周开始直到成年不同发育阶段的组织,主要为心脏组织
研究技术:RNA-Seq、lncRNA-miRNA-mRNA 调控网络分析
研究摘要:
本研究使用人类器官发育的转录组数据,构建了涉及与 CHD 相关 CNVs 中的 CNV-lncRNAs 和蛋白质编码基因的共表达网络,并展示了在 10 个非综合征 CHD 相关 CNVs 中的CNV-lncRNAs 聚集在最显著的心脏相关模块中,并且与多个关键 CHD 基因高度相关地共表达。在 15q11.2 区域内的 HSALNG0104472 被确定为一个具有心脏偏向表达的枢纽 CNV-lncRNA,并已通过实验验证。研究结果表明,HSALNG0104472 应该是一个主要效应因子,负责通过调节心肌细胞分化来导致 15q11.2 缺失的心脏缺陷。我们的发现表明,CNV-lncRNAs 可能潜在地促成了最大比例 68.4%(13/19)的非综合征 CHD 相关 CNVs 的病理。这些结果表明,解释与 CHD 相关的 CNVs 的发病机制应考虑非编码区域。
研究路线:
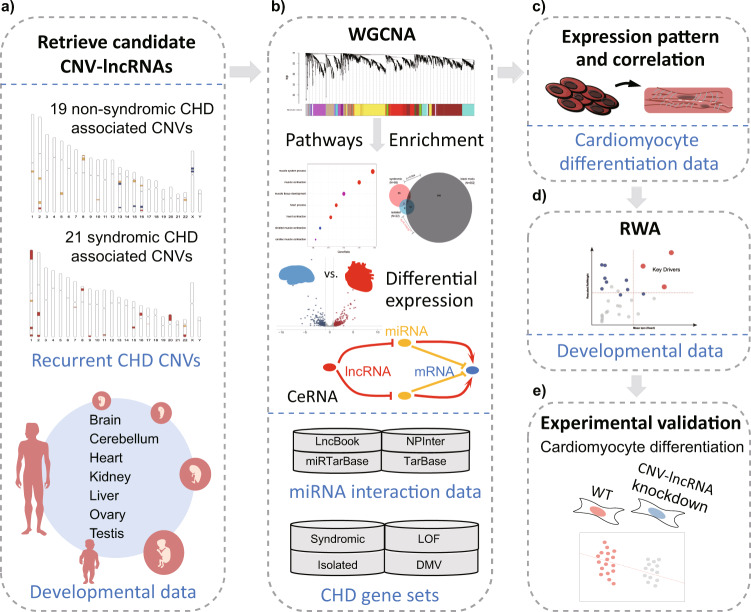
图1 研究路线
部分结果展示:
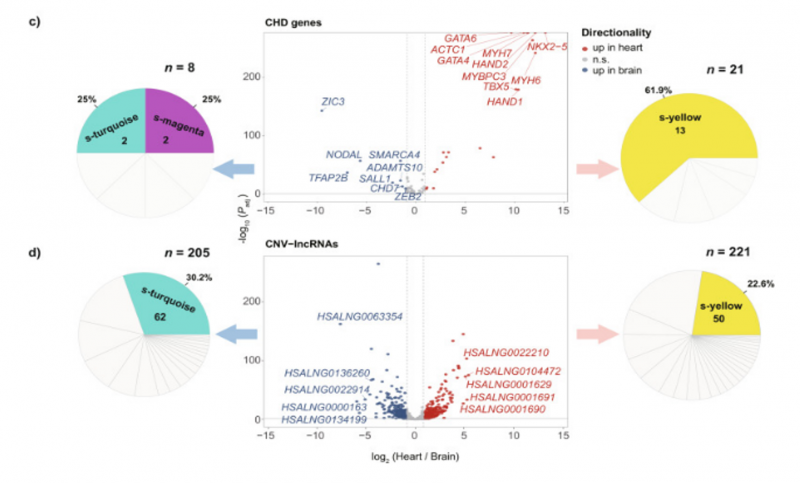
图2 火山图显示了每个聚类中差异表达最显著的CHD基因和CNV-lncRNAs
案例二、biomarker及内源性竞争RNA调控研究——鉴定宫颈癌lncRNA和环状RNA等biomarker及ceRNA分析[2]
研究目的:研究宫颈癌lncRNA和环状RNA致病分子调控机制
研究样本:选取3个病人(HPV16)的宫颈鳞癌组织和癌旁组织。三个生物学重复样本混样(患病 vs 正常)
样本处理: 选取癌组织旁边2cm的癌旁组织,切除后即加入RNA later保护剂中30分钟,随后放入液氮中冷藏。
研究技术: 经济型模式-两种文库测序:
*去核糖体建库测序方式-研究mRNA、lncRNA、环状RNA;
*小片段建库测序方法-研究miRNA;
研究结果:共鉴定到差异表达的19个lncRNA,99个环状RNA,以及304个mRNA 非编码RNA中鉴定到3个新lncRNA和44个新环状RNA,并对这些差异RNA进行功能富集分析。另外,共表达分析和功能预测中,发现19个差异表达lncRNA在致癌和癌症发展中具有重要作用,ceRNA网络分析表达和非表达RNA的相互作用,研究每一个miRNA靶向作用的lncRNA和Mrna竞争关系。发现一些miRNA可以靶向未知的lncRNA,说明这些非编码RNA可能与宫颈癌有关。
研究结论:此次研究结果表明,非编码RNA将有可能作为宫颈鳞癌治疗和诊断的biomarker。CeRNA网络研究在未来宫颈鳞癌研究中将对编码RNA和非编码RNA的关系及重要作用研究的将是重要的分析工具。 
图3 CeRNA网络分析,包含lncRNA、miRNA和mRNA
(A)包含所有lncRNA/miRNA和miRNA/mRNA互作关系
(B) lncRNA-LNC_000188的ceRNA竞争网络
(C)LNC_000231的ceRNA竞争网络.
每个节点的大小与每个节点的计算功能连接性成比例
案例三、biomarker及内源性竞争RNA调控研究——鉴定宫颈癌lncRNA和环状RNA等biomarker及ceRNA分析[3]
研究目的:研究非编码RNA参与调控次级毛囊(SHFs)细胞凋亡发生的分子机制。
研究样本:生物学重复样本-三只羊,绒山羊毛发生长初期阶段和中期阶段(catagen vs. anagen)的皮肤,各三个重复。
研究技术: 经济型模式-两种文库测序:
*去核糖体建库测序方式-研究mRNA、lncRNA、环状RNA;
*小片段建库测序方法-研究miRNA;
研究结果:共鉴定到1122个已知和403个新lncRNA,其中173个lncRNA差异表达;另外鉴定到3500差异表达的Mrna表达转录本;411个已知miRNA和307个新miRNA,包含72个差异表达miRNA;进而对lncRNA的顺势和反试调控靶基因进行鉴定,发现,lncRNA和miRNA在毛囊发育过程之中具有重要的系统调控作用,比如生长中期诱导物因素(TGFβ1和BDNF)是由miRNA-873和lnc108635596 lncRNA-miRNA-Mrna调控网络共同调控。
研究结论:阐明了在皮肤细胞凋亡和抗凋亡的分子相互作用,为毛囊退化提供深入的研究提供指导。

图4 LncRNA–miRNA–mRNA 调控网络图
环形表示 miRNA、方形表示编码基因、三角形表示 lncRNA. 红色代表上调,绿色下调(初期/中期)
参考文献:
[1] Lu Y, Fang Q, Qi M,et al. Copy number variation-associated lncRNAs may contribute to the etiologies of congenital heart disease. Commun Biol. 2023 Feb 17;6(1):189.
[2] Wang H, Zhao Y, Chen M and Cui J (2017) Identification of Novel Long Non-coding and Circular RNAs in Human Papillomavirus-Mediated Cervical Cancer.Front. Microbiol. 8:1720.
[3] Zhou G, Kang D, et al. Integrative analysis reveals ncRNA-mediated molecular regulatory network driving secondary hair follicle regression in cashmere goats. BMC Genomics. 2018 Mar 27;19(1):222.

图1 差异表达基因和差异表达miRNA靶基因韦恩图
Target 表示差异miRNA的靶基因,mRNA表示差异mRNA对应的基因

图2 交集基因的表达量热图

图3 差异表达miRNA和差异靶基因的调控网络分析图

图4 差异表达lncRNA与靶基因的蛋白互作和共表达互作网络图

图5 差异ceRNA—mRNA互作网络图
表1 全转录组测序样品判定标准
|
总量 |
浓度 |
RIN |
纯度 |
|
|
Total RNA (Human / Rat)-经济型 |
≥400ng |
≥20ng/μL |
RIN≥6.0 |
28S/18S≥1.0 无DNA,蛋白/盐离子等污染,样本无色透明不粘稠 |
|
Total RNA (Human / Rat)-大容量型 |
≥2.4μg |
≥20ng/μL |
RIN≥6.0 |
|
|
Total RNA(Plant/Animal)-经济型 |
≥2 μg |
≥40 ng/μL |
RIN≥6.0 |
|
|
Total RNA(Plant/Animal)-大容量型 |
≥4 μg |
≥40 ng/μL |
RIN≥6.0 |
Q1:全转录组产品两种技术模式如何选择?
全转录组有两种模式,一种为经济型,即采用两种建库测序模式;一种为大容量型,即采用三种建库测序模式;主要区别在于环状RNA研究方式不同,一个是对环状RNA广谱研究,即对环状RNA表达情况初步研究; 二是对环状RNA单独富集建库测序,即可实现对环状RNA高深度研究,以及低表达环状RNA的鉴定和定量分析等。所以如果选择两种模式,是需要根据研究目的和需求决定的,以及对RNA研究深度需求决定的。
Q2:全转录组送样量要求?
需要根据选择的研究模式决定,是满足两种建库测序模式(LncRNA+Small RNA)总量需求:Total RNA最低起始量400ng ,还是满足三种建库测序模式(LncRNA+Small RNA+CircRNA)总量需求:Total RNA最低起始量2.4ug。
Q3:长链非编码RNA建库测序结果可以用于分析环状RNA吗?
可以,长链非编码RNA建库模式采用去核糖体方式建库,对所获得的RNA进行打断测序,相当于获得全部RNA,即可以进行分析环状RNA表达情况,可应用于分析各物种环状RNA表达谱。
Q4:LncRNA测序数据中mRNA的定量效果如何?
人标品:已知mRNA定量与qPCR定量斯皮尔曼系数达到0.88。

