- 首页 > 空间蛋白组
空间蛋白组
细胞异质性(heterogeneity)是一个普遍存在的生物学现象,即使看起来相同的细胞,也可能存在显著异质性。同时细胞间对应的空间背景信息,对于充分了解细胞功能、细胞间相互作用以及细胞异质性也是至关重要的。常规研究从整个组织或数百万细胞入手,得到的是一群细胞中信号的平均值,且缺少细胞的空间信息,难以满足对生命功能深入探究的需要。空间蛋白质组可以精细获得组织内不同细胞和功能区域的蛋白表达谱,通过将空间与细胞类型信息与蛋白质组数据联系起来,从而深入了解组织空间微环境并发现更精准的生物标志物和新的功能机制。
目前空间蛋白质组的研究手段包括基于抗体识别的多路组织成像技术、基于手术刀解剖的区域分辨率蛋白质组学和基于激光显微切割(LCM)的空间蛋白质组学。基于 LCM 的空间蛋白质组学技术表现为较好的空间分辨率和蛋白覆盖度,通过高精度 LCM 切取感兴趣的组织区域或细胞,经过超微量样本无损提取并酶切蛋白为肽段,进而使用高灵敏度质谱,对不同空间位置的不同细胞类型的蛋白质表达进行差异分析。
产品优势
- 蛋白鉴定深度高,0.05 mm2×10 μm 样本鉴定数达 3,000+,0.01 mm2×10 μm 样本鉴定数达 1,600+,0.002 mm2 ×10μm鉴定数 1,000 左右;
- 蛋白定量稳定性高,基于 timsTOF Pro 的 4D 蛋白质组分析,对微量样本实现高精度、高深度、高稳定性蛋白质组分析;
- 蛋白定量准确性高,四张连续切片的四个重复之间相关性达到 0.99;
- 组织样本到数据全流程服务;
- 蛋白组信息可对应空间信息,有全扫能力;
- 有领域专业文章背书;
- 华大整体在时空领域的优势,时空转录组、时空蛋白转录组、空间代谢组等,覆盖全流程空间组学。
产品应用
- 肿瘤微环境异质性研究
- 空间蛋白组图谱研究
- 疾病生物标志物研究
技术路线
使用高分辨率的质谱仪对目标样品进行分析,根据一级质谱相关的肽段峰强度、峰面积、液相色谱保留时间等信息进行定量分析。进而筛选和寻找任何因素引起的样本之间的差异表达蛋白。
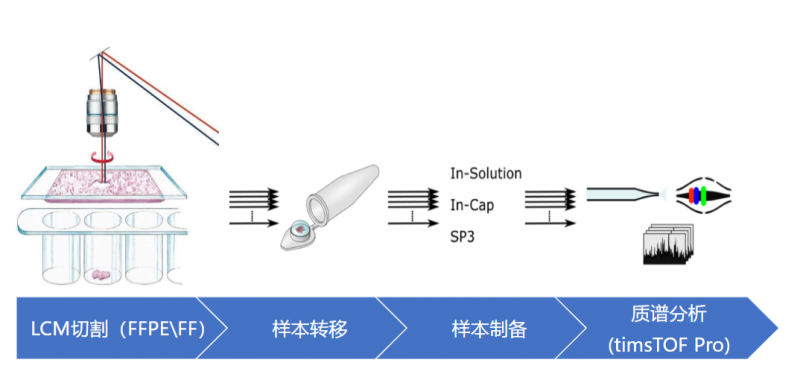
信息分析流程

案例一、胃印戒细胞癌空间蛋白组学研究(项目文章)[1]
实验背景:
胃印戒细胞癌 (SRCC) 是世界卫生组织 (WHO) 定义的胃癌的组织学亚型,主要或完全由印戒细胞组成,其特征是中央可见透明的胞浆粘蛋白球状液滴,细胞核偏心性放置。与全球胃癌发病率呈下降趋势相反,SRCC 发病率持续上升。与 SRCC 相关的病理和药理学的分子特征在胃癌研究的前沿领域具有很高的吸引力。SRCC 不仅在组织学上有其特殊性,而且在临床病理特征上也与其他亚型胃癌不同,SRCC 与腺癌 (ACs) 相比在多方面具有明显的特异性。由于缺乏对这种疾病的系统分子概述导致其临床实践进展缓慢。
实验设计:
从 2,500 例病例中严格筛选 48 例胃癌组织,包括 14 例 SRCC、17 例 PDA C和 17 例 WMDAC,并在组织学检查的基础上对病例进行全面评估。使用LCM将肿瘤和邻近组织很好地分离,采用 DIA 蛋白质组学对 SRCC、PDAC 和 WMDAC 的胃组织的蛋白质组进行了大规模的定量分析。
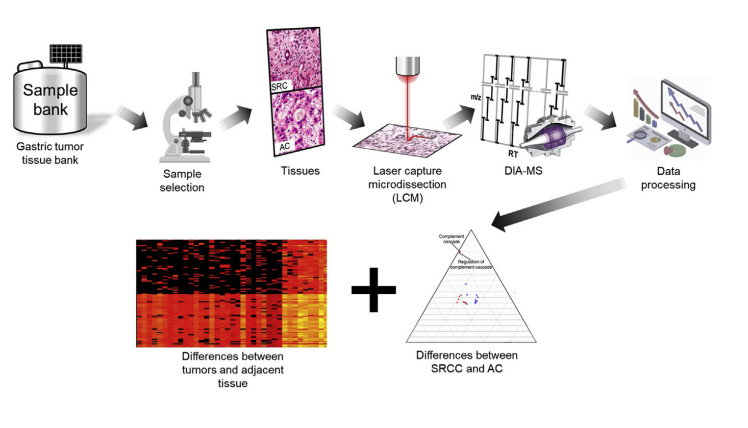
图1 实验流程
主要结果:
严格筛选 48 例肿瘤及癌旁组织,包括 14 例 SRCC、17 例 PDAC 和 17 例 WMDAC。由于肿瘤细胞在切除的肿瘤组织中分布不均匀,为了获得肿瘤细胞含量高的组织,采用LCM采集瘤内异质性低的组织进行蛋白提取。通过 DIA 蛋白质组学分析,鉴定到6,195个蛋白质,每个样本平均包含 4,835 个蛋白质。
对 6,000 多个蛋白质的定量分析,单变量分析和通路富集分析发现 SRCC 和 ACs 之间的一些蛋白质和途径存在差异。首次发现了 SRCC 组织中大量补体级联通路中的蛋白质高度敏感,同时大多数补体相关蛋白在 SRCC 中显著上调,而在 ACs 中则没有。
基于蛋白质组学分析结果,提出了一种假说,即 SRCC 微环境中浸润诱发补体级联,SRCC 细胞通过分泌内源性负调节因子而在补体细胞毒性中存活。通过上调补体负调控因子来逃避补体诱导的细胞死亡是 SRCC 的一个显著特征,而靶向 CRPs 可能是抑制 SRCC 的有效途径。
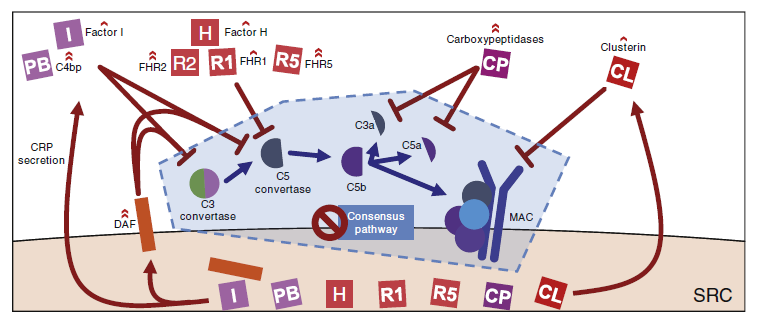
图2 假定的补体调控机制
案例二、结直肠癌空间蛋白组研究(项目文章)[2]
实验背景:
结直肠癌是全球发病率和致死率排名第三的常见癌症。结直肠肿瘤组织(Bulk)由癌变的上皮组织细胞(Epithelium)和其周围的间质(Stroma)构成,间质细胞群(Stroma)即肿瘤微环境为肿瘤发生提供了必要的外在环境。在结直肠癌的分子分型中,间质细胞高度浸润的亚型存在较差的预后。结直肠癌的发生经历了正常上皮细胞-腺瘤-腺癌(N-A-C)的发展过程,并伴随一系列基因突变。在 N-A-C 的时序模型中,其对应的肿瘤微环境也在变化,影响着肿瘤的发生,但相关机制研究较少。
实验设计:
本研究利用 LCM 技术和 DIA 定量蛋白质组学方法研究结直肠癌间质的蛋白质表达谱,探究间质在结直肠癌发展的时序变化中的蛋白质组表达谱特征。
收集癌旁、腺瘤和腺癌三种类型组织样品,采用 LCM 技术对 Epithelium 和 Stroma 进行切分收集,同时收集 Bulk 样品,采用 DIA 蛋白定量技术对三种样品类型进行检测。最后,结合之前结直肠癌研究与序贯模型对 Stroma 进行分析。
主要结果:
通过对 LCM&DIA 的空间蛋白质组技术,可以很好地对 Stroma 和 Epithelium 样本进行分离研究,其区域的分子特征符合区域的功能特征;
通过对Stroma样本不同时期蛋白质组分析,发现与结直肠癌细胞的逐渐改变不同,微环境的改变主要发生在癌旁-腺瘤时期,而在腺瘤-腺癌中基本不发生改变;
腺瘤/腺癌微环境的主要特征是高度的免疫T细胞浸润,免疫相关功能的显著激活。
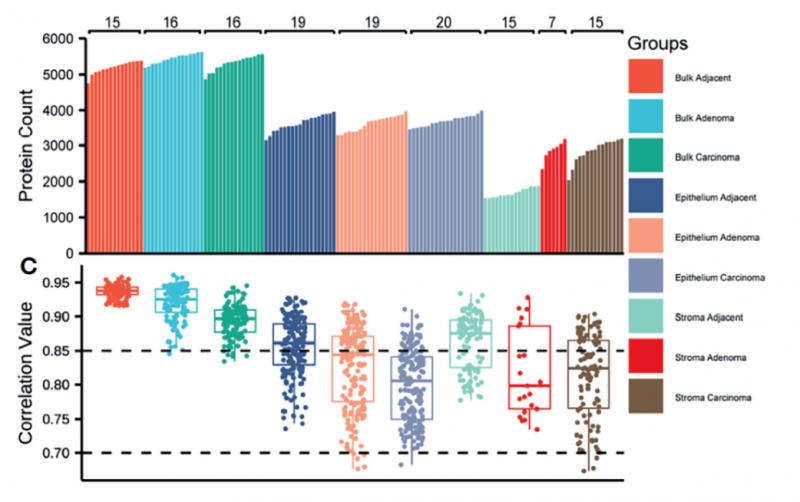
图3 结直肠癌空间蛋白组部分结果
参考文献:
[1] Proteomic Profiling of Gastric Signet Ring Cell Carcinoma Tissues Reveals Characteristic Changes of the Complement Cascade Pathway. Mol Cell Proteomics. 2021.
[2] The Comparable Microenvironment Shared by Colorectal Adenoma and Carcinoma: An Evidence of Stromal Proteomics. Front Oncol. 2022.
结果展示
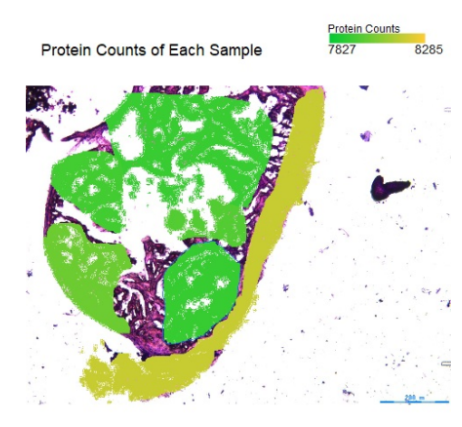
图1 空间区域及蛋白鉴定数分布图
*低鉴定数标记为绿色,高鉴定数标记为黄色
其他蛋白鉴定、蛋白定量、功能注释等结果展示请参考DIA蛋白定量分析。
可接受新鲜组织、石蜡组织样本块、石蜡切片、OCT组织样本块、冰冻切片等多种样本类型。
表1 样品送样要求
|
切片位置 |
切片厚度及面积要求 |
切片数量 |
运输条件 |
|
|
新鲜组织样本 |
|
|
|
放置在2ml样本管或离心管中,干冰寄送 |
|
石蜡组织样本块 |
|
|
|
石蜡有保护作用,常温运输即可 |
|
石蜡切片 |
切片中的组织区域应在金属薄片的膜区域内,如果样本太大,需尽量保证感兴趣区域在金属膜内 |
6~10μm |
≥3 |
不染色可常温,染色后需干冰运输 |
|
OCT组织样本块 |
|
|
|
干冰寄送 |
|
冰冻切片 |
切片中的组织区域应在金属薄片的膜区域内,如果样本太大,需尽量保证感兴趣区域在金属膜内 |
8-10μm |
≥3 |
干冰运输 |
Q1:可以寄送新鲜组织样本吗?
A1:可以,但由于新鲜组织没有OCT保护,容易造成样本内部结构变化;所以更建议提供OCT包埋后组织块。若提供新鲜组织,需将其放置在2ml样本管或者离心管中,干冰寄送。每天干冰消耗量约为3kg,需估算寄送时间和干冰量。
Q2:可以寄送石蜡组织块吗?
A2:可以,可接受新鲜组织、石蜡组织样本块、石蜡切片、OCT组织样本块、冰冻切片等多种样本类型。

